所有酸的酸性强弱排序
依酸性由大到小排序,常见酸的酸性强弱顺序如下:
1、强酸有高氯酸、氢碘酸、硫酸、氢溴酸、盐酸、硝酸、碘酸;
2、中强酸有草酸、亚硫酸、磷酸、丙酮酸、亚硝酸;
3、弱酸有柠檬酸、氢氟酸、苹果酸、葡萄糖酸、甲酸、乳酸、苯甲酸、丙烯酸、乙酸、丙酸、硬脂酸、碳酸、氢硫酸、次氯酸、硼酸、硅酸、苯酚、硅酸、HCN。
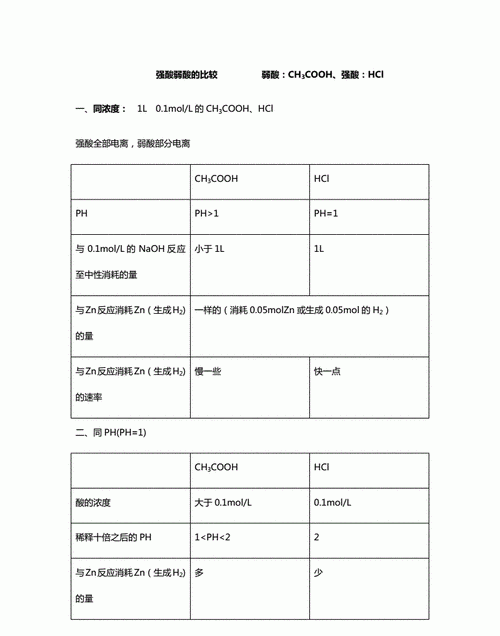
碳酸和亚硝酸谁的酸性强
从两种酸的电离常数可以看出亚硝酸酸性强。
亚硝酸ka=7.24*10^-4
碳酸ka1=4.45*10^-7 , ka2=4.69*10^-11
酸根的酸性强弱,比的是在水中电离的情况.因为亚硝酸根较碳酸根稳定,故亚硝酸根较弱.
亚硝酸根具体:在同一电子层中,电子的能量还稍有差异,电子云的形状也不相同。因此电子层还可分成一个或n个电子亚层。
K层只包含一个s亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f四个亚层。
每个轨道可以有2个电子
当一个电子层里的电子 满了 或者 是一半是``就较稳定
N的原子结构为 2 5
当显+3价是 为 2 2
正好是两个电子在一个轨道,所以稳定

羧酸酸性强弱顺序口诀
酸性由强到弱依次是乙二酸、甲酸、乙酸.因为乙二酸是二元酸,电离出的氢离子最多,所以酸性最强,又羧酸的溶解性随分子量的增大而减小,所以甲酸电离出的氢离子比乙酸多,所以酸性比它强。氢氟酸怎么会在三大强酸前呢?
那可是弱酸,只是氧化性强吧盐酸硝酸硫酸三种强酸酸性不相上下,在水溶液中可视作相等(水具有拉平效应)弱酸的从强到弱顺序为:磷酸、氢氟酸、冰醋酸(纯的醋酸)、碳酸、次氯酸、硅酸
醋酸碳酸碳酸氢哪个强
当然是醋酸酸性强,从碳酸(或碳酸氢钠)和醋酸可以制取二氧化碳这个反应中就可以看出!
Na2CO3+2CH3COOH=2CH3COONa+CO2↑+H2O
NaHCO3+CH3COOH=CH3COONa+CO2↑+H2O
醋酸和碳酸谁腐蚀性强
醋酸酸性强,因为醋酸可以制出碳酸。
强酸制弱酸2CH₃COOH+Na₂CO₃=2CH₃COONa+CO₂+H2O。
纯的无水乙酸(冰醋酸)是无色的吸湿性固体,凝固点为16.6℃(62℉),凝固后为无色晶体,其水溶液中呈弱酸性且蚀性强,蒸汽对眼和鼻有刺激性作用。
扩展资料
乙酸(醋酸)的晶体结构显示 ,分子间通过氢键结合为二聚体(亦称二缔结物),二聚体也存在于120℃的蒸汽状态。
二聚体有较高的稳定性,已经通过冰点降低测定分子量法以及X光衍射证明了分子量较小的羧酸如甲酸、乙酸在固态及液态,甚至气态以二聚体形式存在。当乙酸与水溶和的时候,二聚体间的氢键会很快的断裂。其它的羧酸也有类似的二聚现象。
乙酸能发生普通羧酸的典型化学反应,同时可以还原生成乙醇,通过亲核取代机理生成乙酰氯,也可以双分子脱水生成酸酐。
乙酸的特征反应
① 酸性 乙酸具有明显的酸性,在水溶液里能电离出部分氢离子,它是一种弱酸。
乙酸的电离常数Ki是1.8×10-5(25℃),其酸性比碳酸(25℃时第一级Ki是4.3×10-7)强。乙酸具有酸的通性。例如,它能使蓝色石蕊试纸变红;能跟金属反应,也能跟碱、碳酸钠和碳酸氢钠等反应。
CH3COOH+NaOH→CH3COONa+H2O
2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O
CH3COOH+NaHCO3→CH3COONa+CO2↑+H2O
② 酯化反应 乙酸跟乙醇在浓硫酸存在下加热,生成具有香味的乙酸乙酯。
用氧的同位素示踪,可以知道上述酯化反应过程中,乙酸分子中的羟基跟醇分子羟基上的氢原子结合成水,其余部分结合成酯。
酸跟醇作用生成酯和水的反应叫做酯化反应。酯化反应是可逆反应,不仅有机酸能发生酯化反应,而且无机酸如硝酸、硫酸等也能跟醇发生酯化反应。例如,浓硝酸跟丙三醇反应生成的酯叫做硝酸甘油酯,它是制炸药的原料。
版权声明:本文来自用户投稿,不代表【匆匆网】立场,本平台所发表的文章、图片属于原权利人所有,因客观原因,或会存在不当使用的情况,非恶意侵犯原权利人相关权益,敬请相关权利人谅解并与我们联系(邮箱:dandanxi6@qq.com)我们将及时处理,共同维护良好的网络创作环境。








